§ 18. Кипение
Рассмотрим второй способ образования пара — кипение.
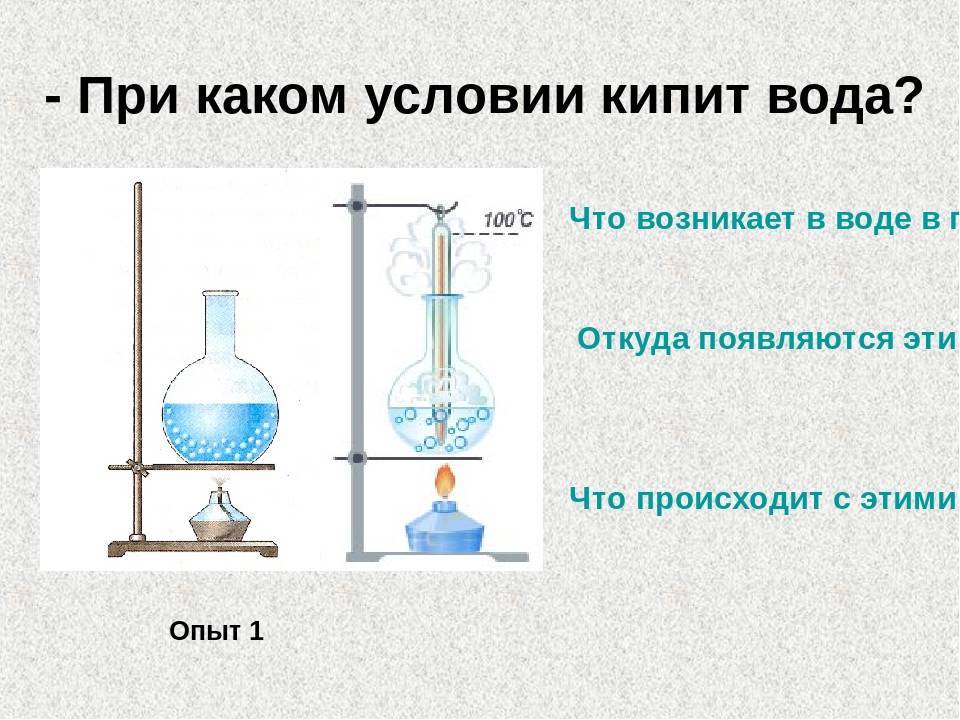
Пронаблюдаем это явление на опыте. Для этого будем нагревать воду в открытом стеклянном сосуде, измеряя её температуру
Прежде всего обратим внимание на то, что с поверхности воды происходит испарение. На это указывает туман, образовавшийся над сосудом.
Это водяной пар смешивается с холодным воздухом и конденсируется в виде маленьких капель. Сам пар, конечно, невидим глазу.
Кипение воды
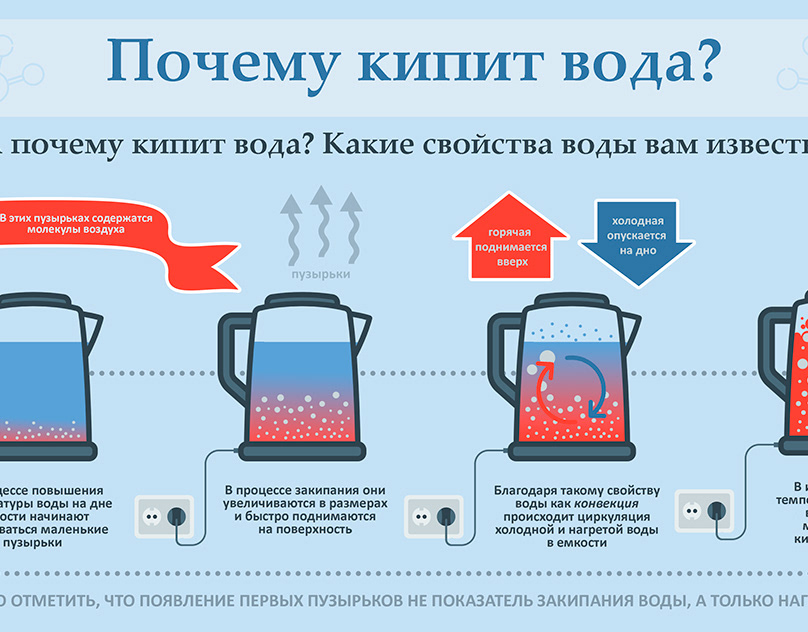
При дальнейшем повышении температуры мы заметим появление в воде многочисленных мелких пузырьков (рис. 21, а). Они постепенно увеличиваются в размерах. Это пузырьки воздуха, который растворён в воде. При нагревании воздух выделяется из воды в виде пузырьков. Эти пузырьки содержат не только воздух, но и водяной пар, так как вода испаряется внутрь этих пузырьков воздуха. Поднимающиеся пузырьки, попадая в верхние, более холодные слои воды, уменьшаются в размерах, так как содержащиеся в них пары конденсируются и под действием силы тяжести они опускаются. Спустившись ниже, в более горячие слои воды, пузырьки начинают снова подниматься к поверхности. Это попеременное увеличение и уменьшение пузырьков в размерах сопровождается характерным шумом, предшествующим закипанию воды. Постепенно вся вода прогревается, пузырьки уже не уменьшаются в размерах. Под действием архимедовой силы они всплывают на поверхность и лопаются (рис. 21,б). Находящийся в них насыщенный пар выходит в атмосферу. Шум прекращается, и мы слышим бульканье — вода закипела.
Рис. 21. Нагревание воды
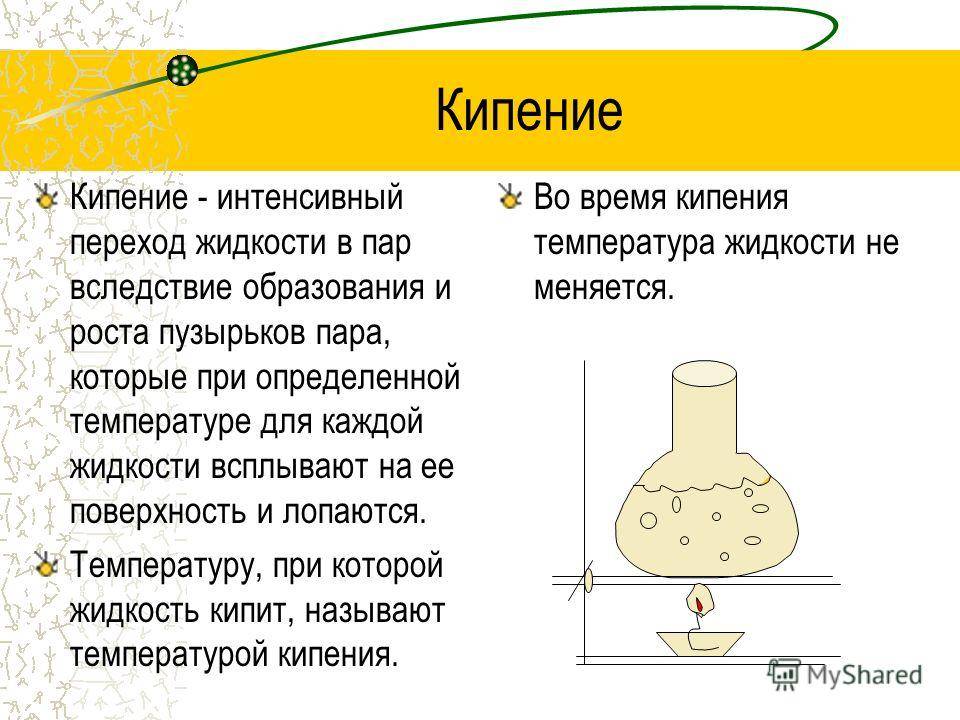
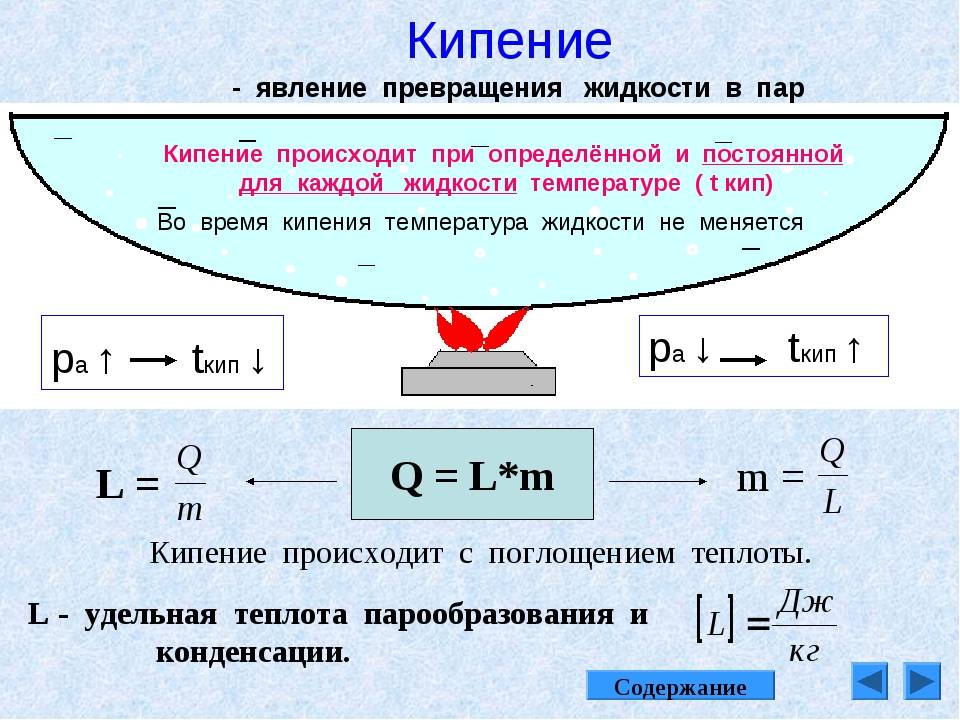
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объёму жидкости при определённой температуре.
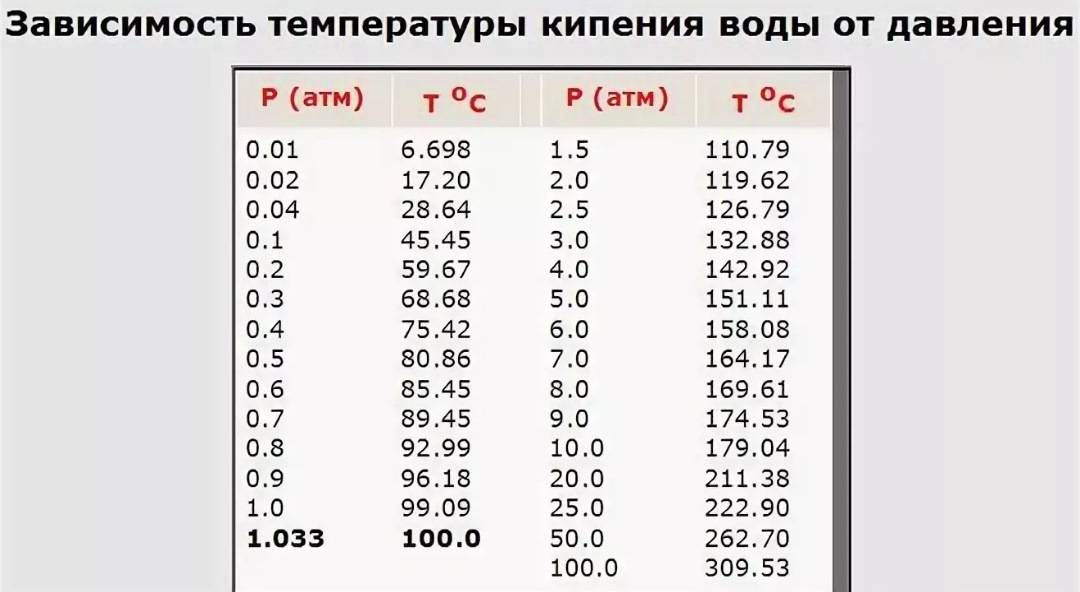
Следует помнить, что у различных жидкостей температура кипения разная (табл. 5).
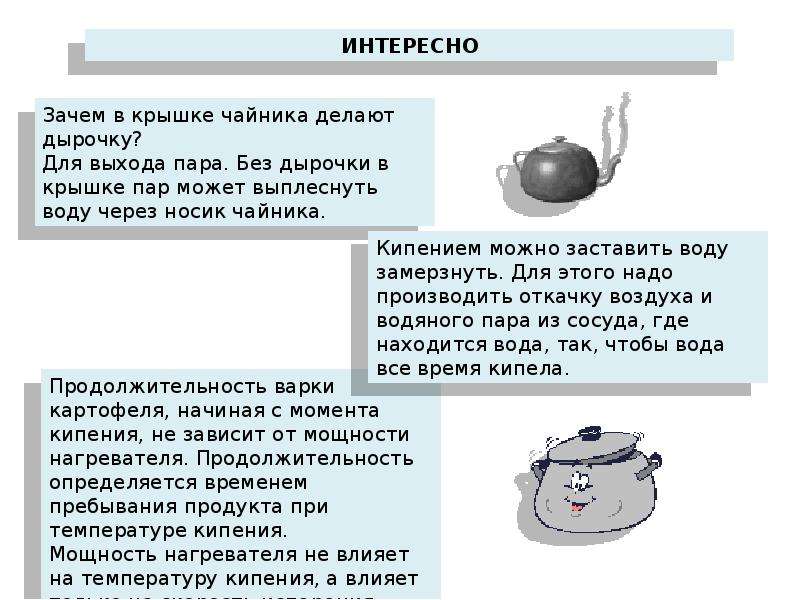
В отличие от испарения, которое происходит при любой температуре (см. § 17 “Поглощение энергии при испарении жидкости и выделение её при конденсации пара”), кипение от начала до конца происходит при определённой и постоянной для каждой жидкости температуре. Поэтому, например, при варке пищи нужно уменьшать огонь после того, как вода закипит. Это даст экономию топлива, а температура воды всё равно сохраняется постоянной во время кипения.
Температуру, при которой жидкость кипит, называют температурой кипения.
Во время кипения температура жидкости не меняется.
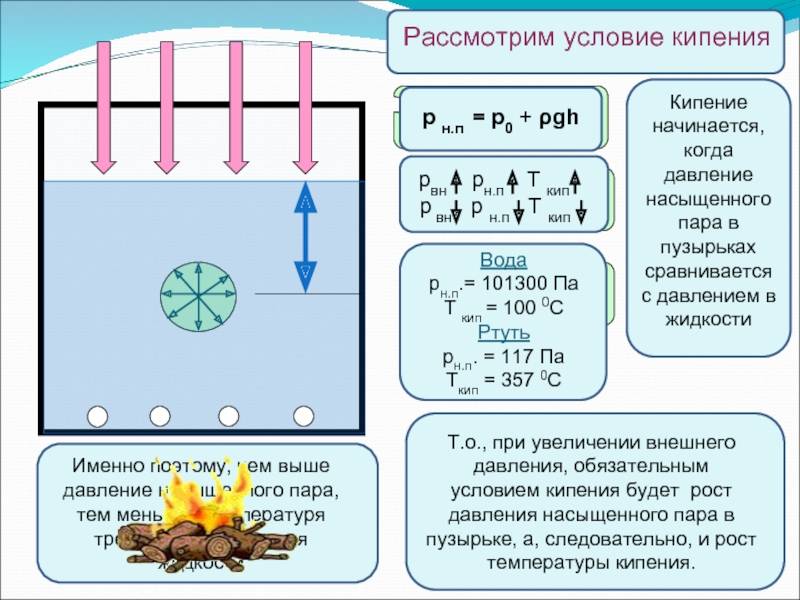
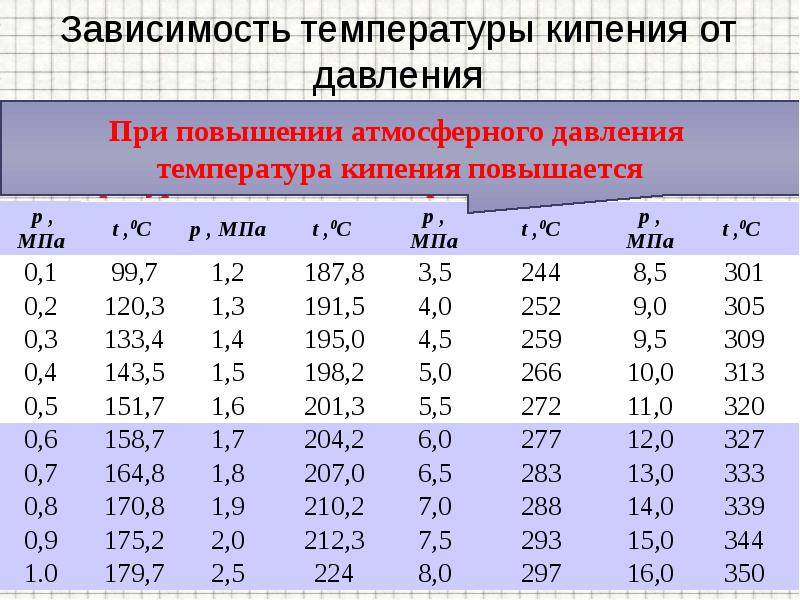
Температура кипения жидкости зависит от давления, которое оказывается на поверхность жидкости. При кипении давление насыщенного пара внутри пузырьков превосходит внешнее давление. Если внешнее давление увеличивается, увеличивается и температура кипения. При уменьшении давления уменьшается и температура кипения жидкости.
Вам известно, что давление воздуха уменьшается с увеличением высоты над уровнем моря. Следовательно, с увеличением высоты уменьшается и температура кипения жидкости. Так, в горах вода закипает при t = 90 °C. При низкой температуре кипения невозможно сварить обычное яйцо, так как белок не может свернуться, если температура ниже 100 °C.
Таблица 5. Температура кипения некоторых веществ(при нормальном атмосферном давлении)
| Вещество | tкип, °C |
| Водород | -253 |
| Кислород | -183 |
| Молоко | 100 |
| Эфир | 35 |
| Спирт | 78 |
| Вода | 100 |
| Ртуть | 357 |
| Свинец | 1740 |
| Медь | 2567 |
| Железо | 2750 |
Некоторые вещества, которые в обычных условиях являются газами, при достаточном охлаждении обращаются в жидкости, кипящие при очень низкой температуре. Жидкий кислород, например, при атмосферном давлении кипит при температуре -183 °C. Вещества, которые в обычных условиях мы наблюдаем в твёрдом состоянии, обращаются при плавлении в жидкости, кипящие при очень высокой температуре. Например, медь кипит при 2567 °C, а железо — при 2750 °C.
Вопросы:
1. Какие явления наблюдаются в жидкости перед тем, как она начинает кипеть?
2. Какие силы действуют на пузырёк воздуха, наполненный паром, когда он находится внутри жидкости?
3. Что называют температурой кипения жидкости?
Упражнения:
Упражнение № 14
1. На рисунке 22 показаны графики зависимости температуры от времени при нагревании и кипении воды, спирта и эфира. Массы жидкостей одинаковы, нагреватели одинаковой мощности. Определите, какой жидкости соответствуют графики 1,2,3.
Рис. 22
2. Нагреется ли вода до более высокой температуры, если её дольше кипятить?
3. Объясните, почему высоко в горах вода закипает при температуре ниже 100 °С.
Задания:
Поставьте на плиту кастрюлю, наполненную водой. Опишите, что происходит с водой по мере её закипания. Объясните наблюдаемое явление.
Предыдущая страницаСледующая страница
Доклад №2
Кипение – интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
Как доказать, что жидкость кипит и парообразуется? – Самый простой способ увидеть такое явление – это наблюдение за кипящей водой в стеклянном сосуде. Например, в колбу нальем обычной воды и доведем ее до кипения, молекулы воды начнут оседать на свободных стенках сосуда, испаряться, стекло запотеет, пойдет пар. Отсюда можно задаться вопросом, а при какой температуре кипят жидкости”? – для каждой жидкости разная температура кипения, всегда стоит учитывать это в решении задач.
Еще один интересный опыт, показывающий кипение жидкости:
Оказывается, соль значительно повышает температуру кипения. Температура кипения повышается потому, что в пузырьках воздуха содержится не только пар исходящий от воды, но и пары поваренной соли.
Во время кипения температура жидкости не меняется. Температура кипения жидкостей зависит от двух факторов: рода вещества, внешнего давления
Так же важно учитывать, что вода быстрее выкипит, если площадь испарения будет большой. Быстрее испаряется та жидкость, молекулы которой притягиваются друг к другу с меньшей силой
Так же не маловажно значение внешних факторов, к примеру – ветра. Насыщенный пар – пар, находящийся в термодинамическом равновесии со своей жидкостью.
Формула, по которой можно расчитать количество теплоты, необходимое для обращения жидкости в пар:
- Q = Lm
- Q – количество теплоты – физическая величина, показывающая, какая энергия предана телу в результате теплообмена.
- L – удельная теплота – теплота, которую необходимо предать единичной массе данного вещества для того , чтобы его температура изменилась на единицу.
- m – масса вещества
Где применяется кипение?
Кипение порой может даже спасти жизнь, это вещь, без которой человечеству не выжить.
- Фильтрация воды путем кипячения. В повседневной жизни и суровых условиях, прокипятив воду, из нее испаряются болезенетворные бактерии и другие вредные для организма микробы. Кипяченую воду можно употреблять.
- Разделение смесей газов жидкости. Температура кипения веществ изменяется только от давления, так разделяют, например, воздух на отдельные газы.
- Варка продуктов, дезинфекция.
- Применение в атомных реакторах и при охлаждении реактивных двигателей.
- Химическая технология.
- Паровые котлы.
- Двигатели.
- Охлаждение элементов электронной аппаратуры.
- Опреснительные установки.
- Холодильная техника.
Без кипения человечеству не выжить.
8 класс по физике
Какова температура пара и емкости?
Пар, формирующийся над кипящей водной поверхностью, хорошо проводит тепло. Он нагревается до 100 С. Но такая его температура только у самой водной поверхности. После выделения на поверхность пар стремительно охлаждается. Его градусы падают. Чем дальше от кипящей поверхности, тем меньше градусов становится у пара.
Температура емкости, в которой происходит кипение, составляет те же 100 С. При данном значении посуда отдает воде нужное для закипания количество тепла. При длительном кипении дно емкости нагревается свыше 100 С.
Если у емкости толстые стенки, то ей для закипания воды внутри нее нужен нагрев чуть более 100 С. Она может разогреться и до 110 С, прежде чем содержимое внутри нее начнет кипеть.
Понятие тепловых явлений
Тепловые явления — это физические процессы, протекающие в телах при их нагревании или охлаждении. То есть это те явления, которые происходят с телами по мере изменения их температуры.
Давайте сделаем небольшую остановку на этом физическом понятии, а потом продолжим.
Температура — мера нагретости тела. Ее можно измерить с помощью термометра, или по-простому градусника. У этого прибора есть множество разновидностей, но в быту чаще всего пользуются ртутными (для измерения температуры человеческого тела), жидкостными (для измерения температуры воздуха или жидкости) и электронными термометрами.
В мире используют несколько температурных шкал: Цельсия, Кельвина и Фаренгейта. На онлайн-уроках физики в школе Skysmart вы подробнее познакомитесь с ними и научитесь легко переводить значения из одной шкалы в другую!
Какие факторы влияют на закипание?
На кипение влияет множество факторов:
- количество воды;
- наличие примесей;
- емкость, в которой она содержится;
- температура окружающей среды;
- высота, где происходит кипячение;
- давление атмосферы;
- мощность источника тепла.
Чем выше изначальная температура воды и воздуха вокруг, тем быстрее начнётся кипение: на нагревание будет затрачено меньше энергии, а значит, меньше времени уйдёт на её получение.
Также часть тепла забирает ёмкость, в которой содержится вода, ведь она должна дойти до нужной температуры ещё раньше, чем ее содержимое. Поэтому посуда с более тонкими стенками, сделанная из легко проводящего тепло материала, например, металла, лучше подходит для кипячения.
От массы, а значит и от объёма вещества, кипение находится в обратной зависимости. Чем больше вес, тем больше энергии требуется на его нагревание, тем дольше будет необходимо ждать.

При прочих равных условиях вода без соли и других примесей закипает несколько быстрее, чем солёная. Однако, если концентрация соли очень низкая, этой разницы может быть практически незаметно.
Давление также влияет на процесс. Чем оно выше, тем дольше будет закипать вода, потому что давление атмосферы как бы удерживает пузырьки газа внутри, а испаряться она начинает тогда, когда давление пара уравнивается с атмосферным.
Соответственно, влияние оказывает также высота, на которой происходит кипячение, ведь с высотой давление уменьшается, как и температура кипения, потому что слой атмосферы сверху становится тоньше.
Эта разница мало заметна, если сравнивать первый этаж жилого дома с пятым, однако становится ощутима, если речь идёт, например, о подъеме в горы.
В вакууме температура кипения всех веществ очень сильно снижается из-за понижения давления, обычно отличие составляет 100-200 градусов. Для воды она стремится к нулю по мере уменьшения количества воздуха, оставшегося в сосуде.
Не менее важны характеристики источника тепла. Чем больше его мощность, то есть количество выделяемой им энергии за единицу времени, тем быстрее идет процесс кипячения. На практике это означает, что на более сильном огне или при большей температуре конфорки на электроплите вода закипит скорее.
Режимы кипения жидкостей – пузырьковое и пленочное кипение
Кипением называется процесс парообразования в толще жидкости. Кипение начинается тогда, когда температура внутри жидкости оказывается выше температуры насыщения (кипения) при данном давлении.
Если в жидкость погружена некоторая поверхность нагрева, температура которой выше температуры насыщения при данном давлении, то на ней возникает процесс парообразования.
Величина перегрева жидкости в момент вскипания по сравнению с температурой насыщения при данном давлении над плоскостью зависит от наличия тех или иных потенциальных центров парообразования (микровпадины, микропузырьки газа, искусственные неоднородности на поверхности нагрева и т.п.).
Эти эффекты имеют значение при малых плотностях теплового потока. Если вся жидкость значительно перегрета против температуры насыщения (например, в результате сброса давления), то паровые пузыри образуются по всей ее толще – жидкость вскипает во всем занимаемом ею объеме.
В зависимости от плотности теплового потока, подводимого к жидкости от поверхности нагрева, на последней возникают отдельные паровые пузыри (пузырьковое кипение) или образуется сплошной слой пара (пленочное кипение).
Пузырьковое кипение
При пузырьковом кипении жидкость непосредственно омывает поверхность нагрева, причем ее пограничный слой интенсивно разрушается (турбулизуется) возникающими паровыми пузырями.
Кроме того, всплывающие пузыри увлекают из пристенного слоя в ядро потока присоединенную массу перегретой жидкости, что создает интенсивный перенос теплоты от поверхности нагрева к общей массе кипящей жидкости.
Следствием этого является высокая интенсивность теплоотдачи при пузырьковом кипении, возрастающая с увеличением числа действующих центров парообразования и количества образующегося пара.
Пленочное кипение
При пленочном кипении жидкость отделена от поверхности нагрева слоем пара, с внешней стороны которого время от времени отрываются и всплывают крупные пузыри. Вследствие относительно малой теплопроводности парового слоя интенсивность теплоотдачи при пленочном кипении существенно меньше, чем при пузырьковом.
Пленочное кипение жидкости
Условия возникновения и перехода от одного режима к другому
Возникновение того или иного вида кипения определяется плотностью теплового потока у поверхности нагрева, ее физическими свойствами (в частности смачиваемостью), физическими свойствами жидкости и гидродинамическим режимом потока в целом.
Таким образом приходится говорить о существовании двух критических плотностях теплового потока.
Первая критическая плотность теплового потока – при которой происходит переход от пузырькового кипения к пленочному, вторая – при которой происходит разрушение сплошного парового слоя и восстановление пузырькового режима кипения.
В области значений плотности теплового потока, лежащих между двумя этими критическими значениями возможно устойчивое существование обоих режимов кипения или даже их длительное совместное сосуществование на разных частях одной и той же поверхности нагрева.
Паровая пленка обычно возникает в отдельных местах поверхности нагрева при достижении значений теплового потока выше критического и далее с конечной скоростью распространяется по всей поверхности нагрева.
Аналогично при снижении теплового потока до значений меньше критического, происходят локальные разрушения пленки с последующим распространением пузырькового кипения на всю поверхность нагрева.
На поверхностях нагрева, обедненных центрами парообразования, процесс кипения имеет нестабильный характер, а интенсивность теплообмена колеблется между условиями конвекции однофазного потока и развитого пузырькового кипения. При этом возможен непосредственный переход от однофазной конвекции жидкости к режиму пленочного кипения.
Применение в теплообменной технике
Изучение условий, при которых возникают различные режимы кипения необходимо для расчета теплообменников, используемых в качестве испарителей.
При появлении пленочного режима кипения эффективность работы испарителя падает и температура охлаждаемой среды на выходе из теплообменника оказывается выше заданной.
Поэтому при расчете и подборе таких аппаратов очень важным является определение плотности тепловых потоков между двумя средами.
Явление кипения жидкости
Определение 1
Кипением называют процедуру активного образования пара во всем объеме жидкости.
Для получения процесса кипения жидкость должна иметь относительно высокую температуру.
В процессе кипения важную роль играют пузырьки газа, которые имеются в жидкости. Ведут себя эти пузырьки следующим образом:
- Они возникают на границе жидкости и твердого тела. Внутри пузырьков находится насыщенный пар жидкого вещества.
- С ростом температуры жидкости давление газа в пузырьке повышается, при этом происходит увеличение объема пузырька.
- В соответствии с законом Архимеда выталкивающая сила, действующая на пузырек, увеличивается при увеличении его объема.
- Создаются условия, при которых сила Архимеда становится равной, а затем и больше, чем сила сцепления пузырька и твердой стенки. В таком случае пузырек будет отрываться от твердой поверхности, всплывать и лопаться. При лопании пузырька происходит выброс пара.
Кипение – это фазовый переход первого рода.
Явление возникновения пузырьков можно корректировать, используя:
- изменение давления;
- воздействуя на жидкость при помощи волн звука;
- ионизацией и др.
Нюансы процесса
Кипение воды в чайнике и кастрюле немного различается между собой, но в обоих случаях оно происходит при 100 градусах. Рассмотрим особенности каждого процесса.
В чайнике
В электрическом чайнике процесс пойдёт быстрее, чем при кипячении в кастрюле, он займёт 3-4 минуты, точное время зависит от конкретной модели и ее мощности. Не потребуется даже выключать прибор – он сделает это автоматически.
Обычный чайник несильно отличается от металлической кастрюли похожей конфигурации и размера, поэтому время закипания у них приблизительно одинаково.
Свист, которым чайник оповещает, что вода кипит, связан с прохождением пара через крышку на его носике.
В кастрюле
 При таком способе кипячения ждать потребуется дольше – около 10 мин. Лучше всего подойдет металлическая кастрюля, она нагреется быстрее, чем емкости из других материалов.
При таком способе кипячения ждать потребуется дольше – около 10 мин. Лучше всего подойдет металлическая кастрюля, она нагреется быстрее, чем емкости из других материалов.
Не стоит наполнять ее до самого верха, потому что в таком случае при кипении брызги будут выплескиваться на плиту. Момент закипания сопровождается громким бурлением. Почти сразу после этого воду можно выключать.
Если накрыть кастрюлю крышкой, можно ускорить нагрев и закипание воды, потому что снизится количество тепла, уходящего в окружающую среду. Однако желательно оставить щель, через которую будет выходить пар.
Кипение жидкости
Главным отличием состояния молекул в жидкости и газе является их разная кинетическая энергия. Молекулы жидкости движутся с относительно небольшими скоростями и находятся близко друг к другу. Молекулы газа движутся значительно быстрее и находятся на больших расстояниях. Следовательно, для перехода в газообразное состояние молекулы должны получить дополнительную тепловую энергию.
Рис. 1. Молекулы в жидкости и в газе
Чем выше температура жидкости, тем большее количество молекул обладают скоростями, достаточными, чтобы оторваться от других молекул и перейти в газ. При некоторой температуре таких «быстрых» молекул оказывается так много, что они всё чаще оказываются рядом, и тогда их энергии хватает, чтобы образовывать пузырёк насыщенного пара внутри слоя жидкости. Пузырёк становится «центром испарения».
Переход жидкости в пар, происходящий одновременно во всем объёме жидкости, называется кипением.
Рис. 2. Кипение жидкости в физике.
Вам крышка
Идею с созданием внутреннего давления можно использовать, даже когда хочешь просто вскипятить воды летом. Обычная крышка на кастрюле позволит вам помыться немного быстрее – с ней вода будет горячее в среднем на 12 °С.
Но не всё так просто. Вселенной есть, чем удивить вас, уважаемые повара. Допустим, вы решили сварганить рагу в духовом шкафу. Выставляем температуру на 140 °С, засовываем гусятницу внутрь, сидим и спокойно наслаждаемся воскресным утром на кухне. В конце концом, температура внутри блюда должна дойти до 100 °С, верно? Нет. Все дело в испарительном охлаждении. Молекулам при испарении требуется огромное количество энергии, которую они попросту забирают у самой жидкости, охлаждая её. Поэтому рагу в открытой посуде в духовке дойдет примерно до 85 °С. Но есть и хорошие новости: это оптимальная температура для приготовления такого блюда.
Физика процесса
Переход вещества из жидкого состояния в парообразное в физике называется парообразованием.
Обратный процесс перехода из газообразного состояния в твёрдое или жидкое, называется конденсация. Например, скопление облаков или наступающий туман.
Выделяют два вида парообразования:
- испарение;
- кипение.
В первом случае необходимо достичь порога температуры плавления, преодолев его. А при кипении у каждого жидкого вещества своя определенная температура, до достижении которой образуется пар.
Область парообразования в этих случаях тоже отличается.
- При испарении пар образуется со свободной поверхности, которая граничит с окружающими ее газами – кислородом и др.
- При кипении образование пара происходит со всего объема жидкости.
Образование пара при кипении
Для наглядности посмотрим, как же образуется пар при кипении на рисунке № 1.
Пузырьки пара образуются во всем объеме жидкости, поднимаются на её поверхность и лопаются, высвобождая горячий пар в в воздух.
Когда вода кипятится, ей передается некоторое количество теплоты, благодаря чему у молекул воды увеличивается внутренняя энергия. Это приводит к тому, что эти молекулы беспорядочно движутся и сталкиваются друг с другом, за счет чего вода закипает.
Пар выделяется в растворенных газах, которые есть в воде. Именно пар как раз и находится в тех пузырьках, которые образуются при кипячении.
Пузырек лопается, чтобы высвободить постоянно увеличивающийся пар. Все это происходит под привыкший для всех нас звук бурления. Но многие пузырьки лопаются внутри воды, не успевая достичь свободной поверхности.
Формула
Физические процессы основаны на формулах. Не является исключением и парообразование.
Если величина будет показывать, сколько теплоты (дж) нужно для обращения жидкости (кг) в пар при испарении при указанной температуре в отсутствие ее изменения, тогда она будет называться удельной теплотой парообразования и конденсации. Обозначается она как L и при расчете используется формула:
Удельная теплота парообразования при различных температурах будет отличаться. Например, при достижении температуры кипения это значение будет самым низким.
Эта величина имеет особое значение во многих сферах производства, например при производстве металлов.
Выяснилось, что когда плавится железо, после его повторного затвердевания возникшая кристаллическая решетка оказывается намного прочнее предыдущей.
Определить удельную теплоту возможно только путем эксперимента, а ее основные значения уже давно установлены. Например, для спирта это 0,9*106, а для воды 2,3*106.
Изменяется удельная теплота парообразования воды и в зависимости от давления. Здесь наблюдается как раз обратная зависимость – когда давление воды увеличивается, снижается значение удельной теплоты парообразования.
При атмосферном давлении в 760 мм рт. ст. удельная теплота парообразования равна 2258 кДж/кг.
Характерным примером может явиться покорение альпинистами высоких гор.
На особых высотах (более 3000 м) из-за пониженного атмосферного давления, уменьшается и температура кипения воды (до 90°С), что усложняет процесс приготовления еды, поскольку требуется больше времени, чтобы произвести термическую обработку пищи.
А на более высоких местностях (около 7000 м.) готовить еду становится практически невозможно из-за падения температуры кипения до 50 °С.
При рассмотрении температуры воды необходимо упомянуть еще одну физическую величину – удельную теплоемкость. Она равняется количеству теплоты, необходимому для передачи единичной массе вещества, чтобы изменить его температуру на единицу.
Если теплота не сопровождается изменением температуры при изменении своего состояния, такая теплота называется скрытой. Скрытая теплота может наблюдаться как раз при парообразовании.
Она также отличается при разных жидкостях и изменяется в зависимости от давления.
При увеличении атмосферного давления и как следствие увеличении температуры жидкости, уменьшается скрытая теплота парообразования.
Какие факторы влияют на закипание?
На кипение влияет множество факторов:
- количество воды;
- наличие примесей;
- емкость, в которой она содержится;
- температура окружающей среды;
- высота, где происходит кипячение;
- давление атмосферы;
- мощность источника тепла.
Чем выше изначальная температура воды и воздуха вокруг, тем быстрее начнётся кипение: на нагревание будет затрачено меньше энергии, а значит, меньше времени уйдёт на её получение.
Также часть тепла забирает ёмкость, в которой содержится вода, ведь она должна дойти до нужной температуры ещё раньше, чем ее содержимое. Поэтому посуда с более тонкими стенками, сделанная из легко проводящего тепло материала, например, металла, лучше подходит для кипячения.
От массы, а значит и от объёма вещества, кипение находится в обратной зависимости. Чем больше вес, тем больше энергии требуется на его нагревание, тем дольше будет необходимо ждать.
При прочих равных условиях вода без соли и других примесей закипает несколько быстрее, чем солёная. Однако, если концентрация соли очень низкая, этой разницы может быть практически незаметно.
Давление также влияет на процесс. Чем оно выше, тем дольше будет закипать вода, потому что давление атмосферы как бы удерживает пузырьки газа внутри, а испаряться она начинает тогда, когда давление пара уравнивается с атмосферным.
Соответственно, влияние оказывает также высота, на которой происходит кипячение, ведь с высотой давление уменьшается, как и температура кипения, потому что слой атмосферы сверху становится тоньше.
Эта разница мало заметна, если сравнивать первый этаж жилого дома с пятым, однако становится ощутима, если речь идёт, например, о подъеме в горы.
В вакууме температура кипения всех веществ очень сильно снижается из-за понижения давления, обычно отличие составляет 100-200 градусов. Для воды она стремится к нулю по мере уменьшения количества воздуха, оставшегося в сосуде.
Не менее важны характеристики источника тепла. Чем больше его мощность, то есть количество выделяемой им энергии за единицу времени, тем быстрее идет процесс кипячения. На практике это означает, что на более сильном огне или при большей температуре конфорки на электроплите вода закипит скорее.
Водно-спиртовой раствор
Дело в том, что водка не является чистым спиртом, а представляет собой раствор воды, в котором присутствует доля спирта. В зависимости от того, какова эта доля, меняется температура замерзания.
«Разброс» значений, при которых водка подвергается кристаллизации, от -27ºС до -34ºС. Это приблизительные показатели. Чем больше этанола в водке, тем ниже будет предел, когда она сможет превратиться из жидкого алкоголя в, так сказать, «алкогольное мороженое».
Интересно следующее: процесс замерзания идет постепенно, водка загустевает, превращаясь в подобие желе, и только после этого, если температура не меняется, становится твердой. И целиком она почти никогда не замерзает.
Причина: сначала меняют свои характеристики частички воды — они становятся маленькими льдинками. Концентрация спирта в бутылке становится выше, поэтому теперь раствору требуется более низкая температура, чтобы он стал льдом.
Вряд ли в холодильнике возможно создание условий, когда градус понизится до -33 или -40. Это в быту просто технически невозможно, даже если морозильная установка исправна. Поэтому полное превращение в лед вам вряд ли доведется наблюдать, а вот куски льда в бутылке – это вполне вероятно.