Примеры решения задач
| Задание | Необходимо приготовить 250 г 6%-ного раствора соли. Вычислите массу воды и соли, необходимую для приготовления подобного раствора. |
| Решение | Запишем формулу для расчета массовой доли растворенного вещества в растворе: |
Отсюда следует, что масса соли, необходимая для приготовления её 250 г 6%-ного раствора будет равна:
Ответ
Масса воды равна 235 г, масса соли равна 15 г.
| Задание | Вычислите массу воды, необходимую для приготовления 50 г 10%-ного раствора соли. |
| Решение | Запишем формулу для расчета массовой доли растворенного вещества в растворе: |
Отсюда следует, что масса соли, необходимая для приготовления её 250 г 6%-ного раствора будет равна:
Меняется ли вес в процессе нагревания?
Вес одинакового объема горячей и холодной воды будет немного отличаться. Из-за большей плотности, тяжелее будет холодная.
Самый большой вес она имеет при 4°С, но, при охлаждении или нагревании относительно этого значения, будет становиться легче.
На практике обычно учитывается не столько изменение веса, сколько различие в объемах горячей и холодной воды.
В большинстве систем вода заперта в ограниченном пространстве, и, если заранее не позаботиться о компенсирующих устройствах, возрастающий объем станет причиной разрыва емкости или трубопровода.
Необходимо учитывать, что разница в весе не слишком велика. Один кубометр воды при 4°С весит ровно тонну, а при 90°С он станет легче на 34,7 кг.
Физическое определение
Согласно физическому определению, плотность — это отношение массы к объему.
То есть, эта величина показывает количество данного вещества, сосредоточенного в определенном объеме.
Если посмотреть на молекулярном уровне, плотность показывает, насколько близко друг к другу расположены молекулы того или иного материала.
Показателем, иллюстрирующим значение этого параметра, может стать соотношение веса 1 л разных жидкостей:
- вода — 1 кг;
- масло — 900 г;
- спирт — 800 г и т.д.
То есть, в одинаковом объеме воды больше, чем масла или спирта. Для обозначения плотности в формулах используется греческая буква ρ (ро).
Сама формула в общем виде выглядит следующим образом:
С изменением температуры плотность веществ изменяется. Это происходит из-за ускорения движения атомов. У воды наблюдается особое соотношение этих параметров.
Значение плотности воды
ПВ не является константой, ее величина зависит, при условии постоянного давления, от двух факторов – температуры и ее «солености». Так, например, плотность чистой пресной воды при температуре 20 °C и давлении 1 атм равняется 998,23 кг/м 3 , а плотность морской воды на поверхности океана ориентировочно 1027 кг/м 3 .
Плотность воды в зависимости от температуры
Ниже приведем изменение плотности чистой воды в зависимости от температуры:
- При – 30 °C — 0,9839 гр/см 3 ;
- При – 20 °C — 0,9935 гр/см 3 ;
- При – 10 °C — 0,9982 гр/см 3 ;
- При 0 °C — 0,99987 гр/см 3 ;
- При 1 °C — 0,99993 гр/см 3 ;
- При 2 °C — 0,99997 гр/см 3 ;
- При 3 °C — 0,99999 гр/см 3 ;
- При 4 °C — 1.00000 гр/см 3 ;
- При 5 °C — 0,99999 гр/см 3 ;
- При 6 °C — 0,99997 гр/см 3 ;
- При 7 °C — 0,99993 гр/см 3 ;
- При 8 °C — 0,99988 гр/см 3 ;
- При 9 °C — 0,99981 гр/см 3 ;
- При 10 °C — 0,99973 гр/см 3 ;
- При 15 °C — 0,99913 гр/см 3 ;
- При 20 °C — 0,99823 гр/см 3 ;
- При 25 °C — 0,99707 гр/см 3 ;
- При 30 °C — 0,99562 гр/см 3 ;
- При 40 °C — 0,99224 гр/см 3 ;
- При 50 °C — 0,98807 гр/см 3 ;
- При 60 °C — 0,98324 гр/см 3 ;
- При 70 °C — 0,97781 гр/см 3 ;
- При 80 °C — 0,97183 гр/см 3 ;
- При 90 °C — 0,96534 гр/см 3 ;
- При 100 °C — 0,95838 гр/см 3 .
Что влияет на этот параметр?
В обычных условиях на параметры воды значительное влияние оказывает степень нагрева. Как правило, у большинства веществ или соединений плотность увеличивается при понижении температуры. Однако, у воды эта зависимость нелинейная.
Показатель достигает максимума при 4°C, понемногу уменьшаясь как при понижении, так и при повышении температуры. При этом, когда вода переходит в твердую фазу (образуется лед), процесс уменьшения плотности при охлаждении продолжается.
Этим объясняется известный (и очень опасный для оборудования) эффект расширения воды при замерзании — из 0,028 м 3 воды получается 0,03 м 3 льда.
 Зависимость физических свойств от температуры наблюдается практически у всех веществ, но только вода демонстрирует это в жидком состоянии.
Зависимость физических свойств от температуры наблюдается практически у всех веществ, но только вода демонстрирует это в жидком состоянии.
При этом горячая вода показывает нелинейный, но относительно ровный график уменьшения значений (по крайней мере, до точки кипения в 100°С).
Теплопроводность воды в зависимости от температуры и давления
В таблице приведены значения теплопроводности воды и водяного пара при температурах от 0 до 700°С и давлении от 1 до 500 атм.
Как известно, вода при атмосферном давлении закипает и переходит в пар при температуре 100°С. Коэффициент теплопроводности воды в этих условиях равен 0,683 Вт/(м·град). При увеличении давления растет и температура кипения воды (закон Клапейрона — Клаузиуса). По данным таблицы видно, при давлении в 100 раз выше атмосферного (100 бар) вода находится в виде пара при температуре от 310°С и имеет теплопроводность 0,523 Вт/(м·град).
Таким образом, следует отметить, что изменение давления влияет как на температуру кипения воды, так и на величину ее теплопроводности. Высокая теплопроводность воды достигается за счет роста давления — при повышении давления коэффициент теплопроводности воды увеличивается. Например, при давлении 1 бар и температуре 20°С вода имеет теплопроводность, равную 0,603 Вт/(м·град). При росте давления до 500 бар теплопроводность воды становится равной 0,64 Вт/(м·град) при этой же температуре.
Примечание: Черта под значениями в таблице означает фазовый переход воды в пар, то есть цифры под чертой относятся к пару, а выше ее — к воде. Теплопроводность в таблице указана в степени 10 3 . Не забудьте разделить на 1000! Размерность теплопроводности воды в таблице Вт/(м·град).
Агрегатное состояние воды
Вода – это наиболее распространенное вещество в природе. Она представляет собой термодинамически устойчивое соединение, способное находиться сразу в трех агрегатных состояниях: жидком, твердом (лед) и газообразном (водяной пар), каждое из которых определяется температурой и давлением (рис. 2).
Рис. 2. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
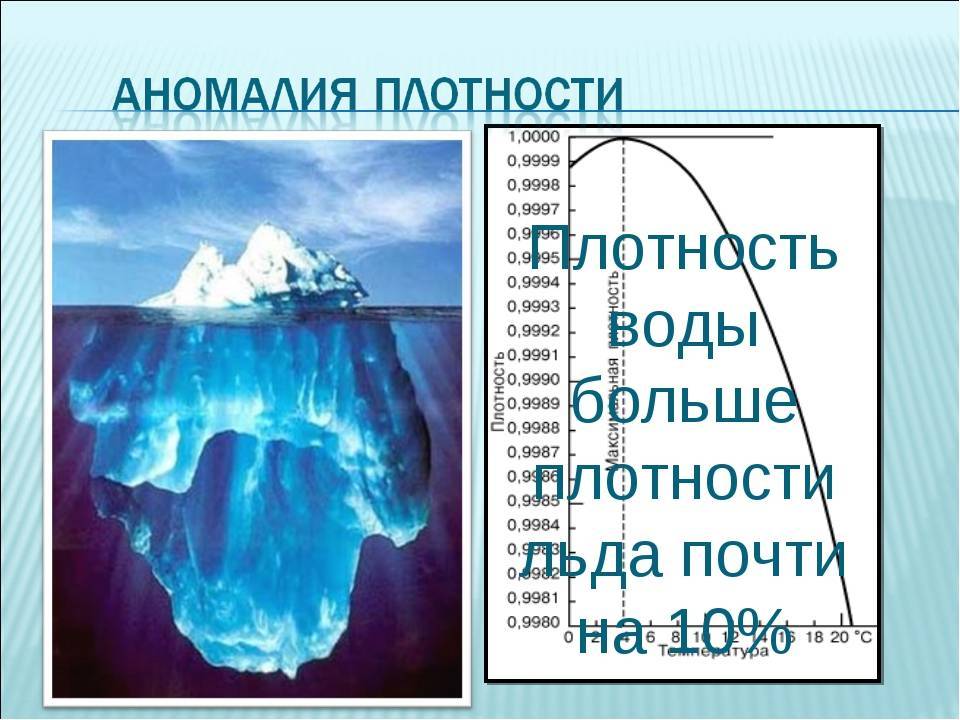
Плотность воды — аномалия
Как мы видим, ПВ в жидком состоянии, вначале, при повышении температуры до 4-х градусов по Цельсию, увеличивается, а далее от 4 °C и выше понижается. Т. е. при 4 °C ПВ достигает своего максимального значения.
С аномалией плотности воды связаны такие факты и явления:
- При замораживании вода расширяет;
- Плотность воды в твердом состоянии — льда ниже, чем ПВ в жидком состоянии;
- У воды низкий коэффициент расширения и сжатия;
- …
Прекрасной иллюстрацией аномалии ПВ является, например, лед. Он не тонет, поскольку его плотность меньше ПВ.
Свойство воды, благодаря которому ее максимальная плотность достигается при +4 °C, имеет огромное значение для всей нашей планеты. Например, благодаря именно этому свойству пруды и другие водоемы замерзают сверху вниз, что позволяет всем формам жизни находящимся в них выжить в период сильных морозов.
Физические свойства воды при температуре от 0 до 100°С
В таблице представлены следующие физические свойства воды: плотность воды ρ, удельная энтальпия h, удельная теплоемкость Cp, теплопроводность воды λ, температуропроводность воды а, вязкость динамическая μ, вязкость кинематическая ν, коэффициент объемного теплового расширения β, коэффициент поверхностного натяжения σ, число Прандтля Pr. Физические свойства воды приведены в таблице при нормальном атмосферном давлении в интервале от 0 до 100°С.
Физические свойства воды существенно зависят от ее температуры. Наиболее сильно эта зависимость выражена у таких свойств, как удельная энтальпия и динамическая вязкость. При нагревании значение энтальпии воды значительно увеличивается, а вязкость существенно снижается. Другие физические свойства воды, например, коэффициент поверхностного натяжения, число Прандтля и плотность уменьшаются при росте ее температуры. К примеру, плотность воды при нормальных условиях (20°С) имеет значение 998,2 кг/м 3 , а при температуре кипения снижается до 958,4 кг/м 3 .
Такое свойство воды, как теплопроводность (или правильнее — коэффициент теплопроводности) при нагревании имеет тенденцию к увеличению. Теплопроводность воды при температуре кипения 100°С достигает значения 0,683 Вт/(м·град). Температуропроводность H2O также увеличивается при росте ее температуры.
Следует отметить нелинейное поведение кривой зависимости удельной теплоемкости этой жидкости от температуры. Ее значение снижается в интервале от 0 до 40°С, затем происходит постепенный рост теплоемкости до величины 4220 Дж/(кг·град) при 100°С.
| t, °С → | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ, кг/м 3 | 999,8 | 999,7 | 998,2 | 995,7 | 992,2 | 988 | 983,2 | 977,8 | 971,8 | 965,3 | 958,4 |
| h, кДж/кг | 42,04 | 83,91 | 125,7 | 167,5 | 209,3 | 251,1 | 293 | 335 | 377 | 419,1 | |
| Cp, Дж/(кг·град) | 4217 | 4191 | 4183 | 4174 | 4174 | 4181 | 4182 | 4187 | 4195 | 4208 | 4220 |
| λ, Вт/(м·град) | 0,569 | 0,574 | 0,599 | 0,618 | 0,635 | 0,648 | 0,659 | 0,668 | 0,674 | 0,68 | 0,683 |
| a·10 8 , м 2 /с | 13,2 | 13,7 | 14,3 | 14,9 | 15,3 | 15,7 | 16 | 16,3 | 16,6 | 16,8 | 16,9 |
| μ·10 6 , Па·с | 1788 | 1306 | 1004 | 801,5 | 653,3 | 549,4 | 469,9 | 406,1 | 355,1 | 314,9 | 282,5 |
| ν·10 6 , м 2 /с | 1,789 | 1,306 | 1,006 | 0,805 | 0,659 | 0,556 | 0,478 | 0,415 | 0,365 | 0,326 | 0,295 |
| β·10 4 , град -1 | -0,63 | 0,7 | 1,82 | 3,21 | 3,87 | 4,49 | 5,11 | 5,7 | 6,32 | 6,95 | 7,52 |
| σ·10 4 , Н/м | 756,4 | 741,6 | 726,9 | 712,2 | 696,5 | 676,9 | 662,2 | 643,5 | 625,9 | 607,2 | 588,6 |
| Pr | 13,5 | 9,52 | 7,02 | 5,42 | 4,31 | 3,54 | 2,93 | 2,55 | 2,21 | 1,95 | 1,75 |
Примечание: Температуропроводность в таблице дана в степени 10 8 , вязкость в степени 10 6 и т. д. для других свойств. Размерность физических свойств воды выражена в единицах СИ.
Сравнение
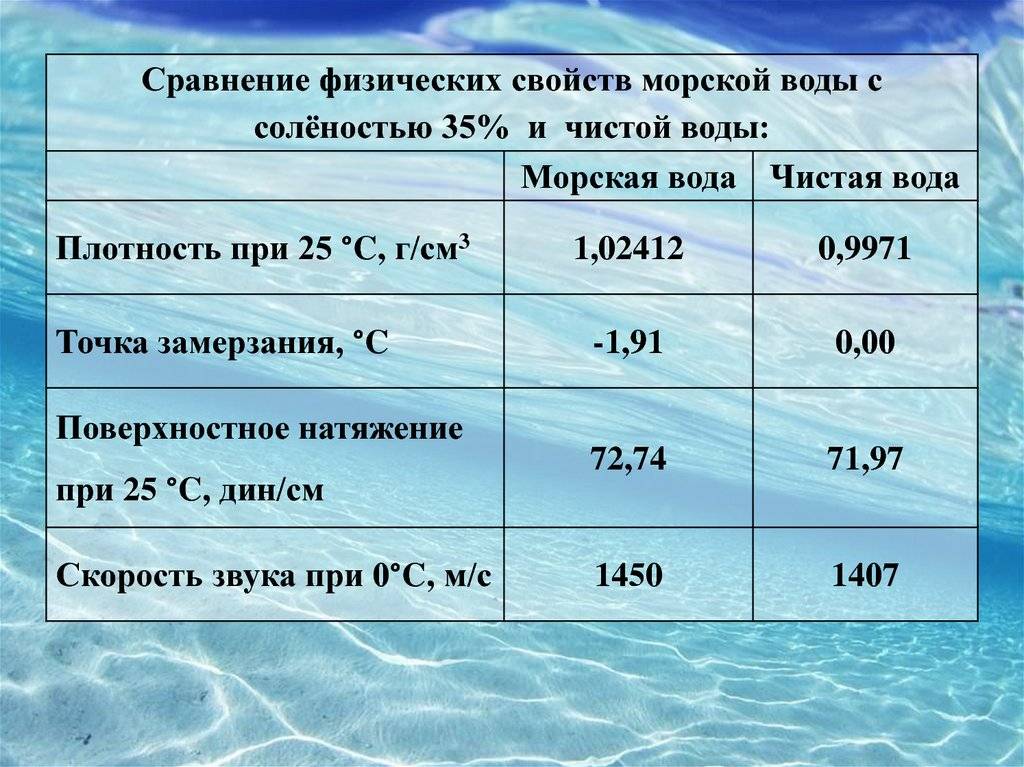
Пресная вода всегда будет менее плотной по сравнению с водами, содержащими соли и минеральные элементы. Возьмем для сравнения морскую и соленую.
С морской
Показатель для морской H2O при солености в 35% (среднее общее значение) составляет 1027,81 кг/м3. Но чем выше концентрация солей, тем она будет плотнее.
При этом наиболее плотной она будет не при положительных значениях температур — +4˚С, а при отрицательных – от -3 °С.
 На плотность и количество солей в морской воде оказывает влияние:
На плотность и количество солей в морской воде оказывает влияние:
- объем выпадающих виде дождей осадков,
- интенсивность испарений с их поверхности,
- температура, до которой нагреваются верхние слои,
- объем приточной речной воды,
- есть ли замерзание и таяние льдов.
С соленой
Плотность любой соленой воды зависит от концентрации в ней различных солей. Чем больше концентрация, тем она более плотная, т.е. будет уже не 999,8 кг/м3, а 1000 кг/м3 и более.
Какая плотнее и почему?
Если сравнивать пресную и морскую воду, то последняя всегда будет плотнее из-за содержания солей. Если говорить о температуре, то чем холоднее вода, тем она плотнее, за исключением той, что нагрета от 0 до 4˚С.
Какая вода плотнее — соленая или пресная, видео-эксперимент:
Проблема пресной воды
Интенсивное использование невозобновляемых водных ресурсов наносит вред экологии. Дефицит воды становится ограничителем экономического роста в развивающихся странах. Рассмотрим основные проблемы.
Нехватка водных ресурсов
Многим кажется, что пресная вода это неиссякаемый природный источник. И подтверждением тому служит круговорот воды в природе. Но не все учитывают человеческую жизнедеятельность, перенаселение планеты и меняющийся в сторону потепления климат.
Огромное количество природных водоемов высыхают, сельскохозяйственная отрасль использует воду неэффективно, а потребляет ее в гораздо большем количестве, чем любая другая промышленность. Все эти факторы приводят к тому, что отсутствие достаточных запасов пресной воды становится все ощутимее.
Пути выхода из сложившейся ситуации, такие как создание водохранилищ, опреснение соленой воды, экономное расходование, пока не дают должных результатов.
Загрязнения
Выделяют природные причины и искусственно созданные причины загрязнений.
К природным относятся те процессы, которые не зависят напрямую от человека:
- грязевые потоки;
- сели;
- наводнения;
- землетрясения.
Искусственные последствия наступают в связи с человеческой деятельностью. Некоторые предприятия нередко пренебрегают экологическими нормативами и требованиями и сбрасывают отходы непосредственно в водоемы.
Выбросы в атмосферу вредных веществ от автомобильного транспорта, фабрик и заводов приводят к кислотным дождям.
Применение этих знаний на практике
Для специалистов-теплотехников или работников ЖКХ, любые изменения параметров потока являются серьезной проблемой.
Приходится использовать компенсаторы объема (у техников они называются расширительные баки), делать резервные линии для отведения избытков.
В природе изменения плотности также имеют свое значение. В зимнее время вода, охлаждаясь до 4°С, опускается на дно водоема, вытесняя наверх более теплые слои.
Если они охлаждаются ниже этого значения, их плотность уменьшается и не позволяет им вытеснить придонные объемы с постоянной температурой 4°С.
Это позволяет защитить водоемы от сплошного перемерзания, сохранить запасы рыбы и прочей водной живности.
Лекция. Химические и физические свойства природных вод
1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода , лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение , поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
Водород и кислород имеют несколько природных изотопов:
2 Н — «тяжелый» водород, или дейтерий),
3 Н — радиоактивный «сверхтяжелый» водород, или тритий).
16 О, 17 О, 18 О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1 Н и 16 О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода ( 3 Н) и «тяжелого» кислорода ( 18 О) меньше, чем океанические воды.
Воду с изотопным составом ‘Н2 16 О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3 Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2 Н2О (или О2О). Вода с изотопным составом 3 Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
Плотность воды
Плотность воды определяется массой единичного объема в килограммах на метр кубический (кг/м3). В водоеме П.в. зависит от таких вещей как: минерализация, температура, количество растворенных солей в воде, ну и, конечно же, от давления высших слоев воды.
Плотность воды химически чистой (обессоленной) зависит от температуры. Их зависимость вычисляется по формуле, которая напоминает параболу с определенной вершиной при t 3,98°С. При такой температуре плотность воды как химического вещества принято считать равной 1000 кг/м3, или же 1г/см3. Если происходит снижение t до 0°С, плотность воды снижается на 0.132 кг/м3, а если же происходит повышение t, то плотность понижается до 995.67 кг/м3 (это при 30°С). Условной П.в. называется разность между плотностью при некоторой температуре (t) и самой большой плотностью (sigma t) approx rho T – 1000. По-другому ее еще называют аномалией П.в. При повышении давления и минерализации П.в. тоже увеличивается. Незначительные изменения плотности воды от всех этих трех факторов играют важнейшую роль при динамике вод в водоемах, в формировании качества воды и их экосистем.
Всем известно, что при повышении температуры вещества увеличивают свой объем и понижают плотность. Вода обладает точно таким же свойством, но в интервале от 0 до 4°С, где с возрастанием температуры объем не повышается, а, наоборот, сокращается, данное свойство не выполняется. Принято считать максимальную плотность воды при температуре 4°С. Отсюда можно сделать вывод, что для воды зависимость объема и температуры двузначна. К примеру, при 0.2 и 8°С масса воды занимает одинаковое количество объема, точно так же как и при 3 и 5°С. Но, не смотря на это, воду принято считать эталоном плотности – при температуре равной 4°С, когда ее масса в 1 грамм имеет объем в 1 кубический сантиметр.
А как изменится объем воды при понижении температуры? Выяснилось, что при t ниже 0°С он будет продолжать увеличиваться, при условии переохлаждения. Но переохлаждение всегда требует сложных условий: неподвижность воды, отсутствия мест кристаллизации льда.
Если вода лишена растворенных в ней газов, то ее можно переохладить до минус 70°С и при этом она не превратится в лед. Но если ее встряхнуть или добавить небольшое количества льда, то она мгновенно покроется льдом и температура ее подскочит до 0°С (на 70°С). Можно так же довести воду до температуры 150°С без закипания, однако если в нее ввести пузырек воздуха, то вода моментально вскипит и температура ее понизится до 100°С.
Вода, при замерзании, внезапно увеличивается в объеме на 11%, так же внезапно и уменьшается при таянии. Это увеличение объема играет огромную роль, как в природе, так и в жизни людей. При замерзании воды и ее дальнейшем увеличении объема, происходит расширение, в результате чего возникает сильное давление, равное 2500 кгс/см2. Именно поэтому замерзающая вода обладает разрушительной силой в замкнутых пустотах, трещинах гор. Именно это объясняет то, как замерзающая вода разрушает многолетние глыбы, превращая их в мелкие осколки или же, как происходят взрывы крупных наледей. Точно так же, при замерзании воды в трубопроводе, происходит расширение труб, а в дальнейшем и их взрывы. Стоит так же сказать, что все эти процессы происходят при абсолютном давлении равном 1 атм.
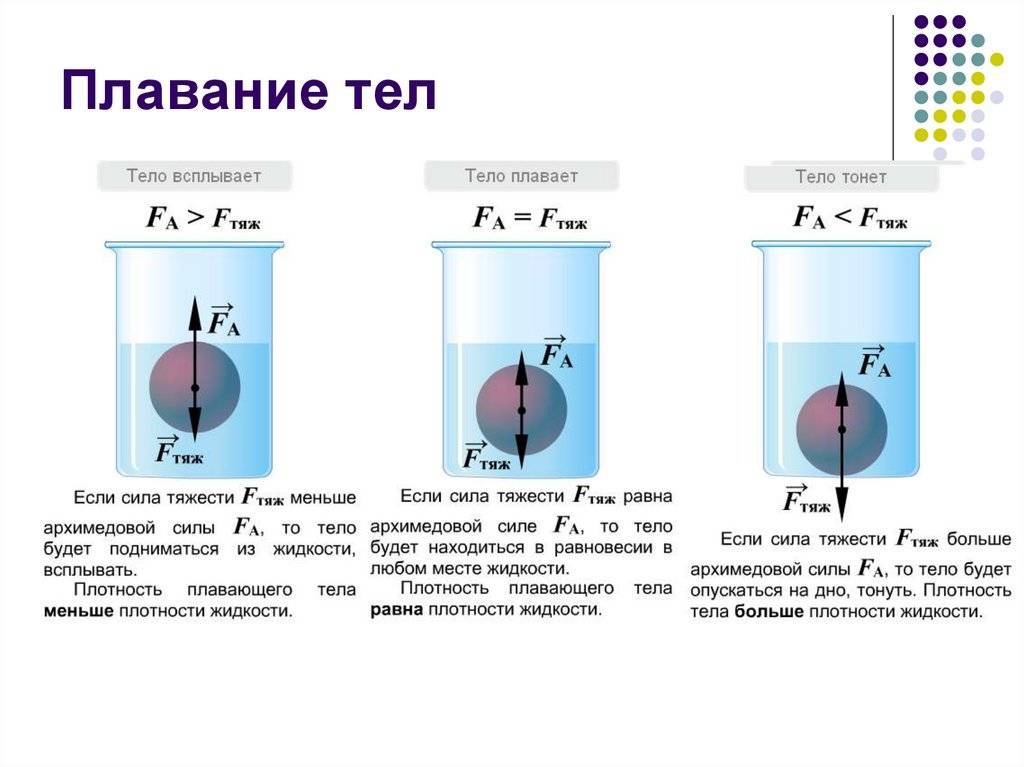
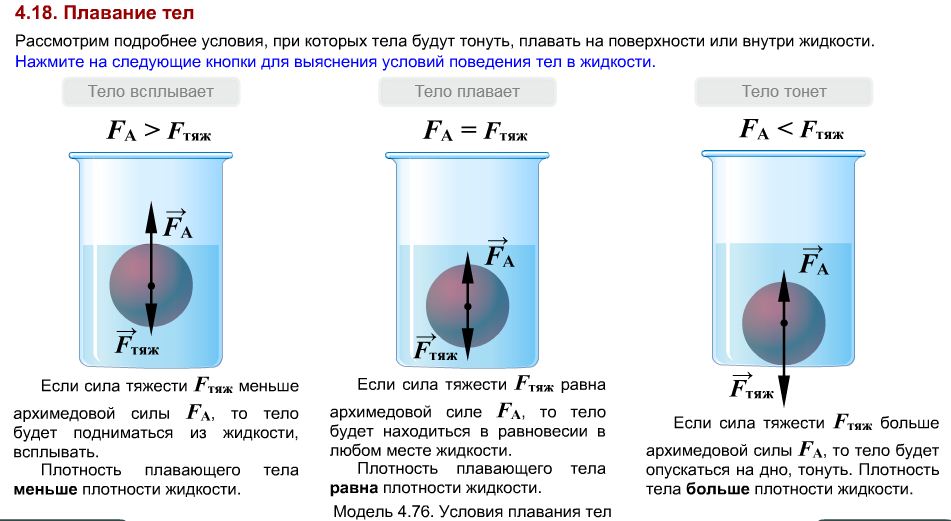
Важно так же то , что максимальная плотность воды отмечается при 4°С, лед оказывается легче жидкости и находится на поверхности. Если бы лед находился внизу водоемов, то они промерзали бы с самого дна, создавая глобальную катастрофу для всех тех, кто обитает в этих водоемах
Читая увлекательные статьи о свойствах физических тел и химических веществ, поневоле завидуешь тем ученым, которые изучают эти процессы, проводя разнообразные лабораторные опыты. Но чтобы стать таким ученым, сначала надо научиться азам, закончив среднее образование и продолжив обучение в ВУЗе с физическим или химическим уклоном. Но для этого сначала необходимо сдать вступительные экзамены, хорошо подготовиться к которым, не обращаясь к услугам репетиторов в наши дни практически невозможно. Вот почему необходимо знать стоимость репетитора и перечень нужных вам предметов. В этом Вам сможет помочь сайт “Дистанционный репетитор”.